
Ihre Probe. Unser Antrieb.
Automatisierung, die sich Ihrem Labor anpasst – nicht umgekehrt!
Keine Neuigkeiten mehr verpassen!
Probenvorbereitung
Automatisierung für die GC, GC/MS, LC, LC/MS oder alleinstehend
Thermodesorption
Flexible und robuste Systeme für die GC/MS
GC-Olfaktometrie
Bestimmung von Aromen, Duftstoffen und Fehlgerüchen
Persönlicher Kontakt
Direkte, individuelle Beratung
Neues bei GERSTEL
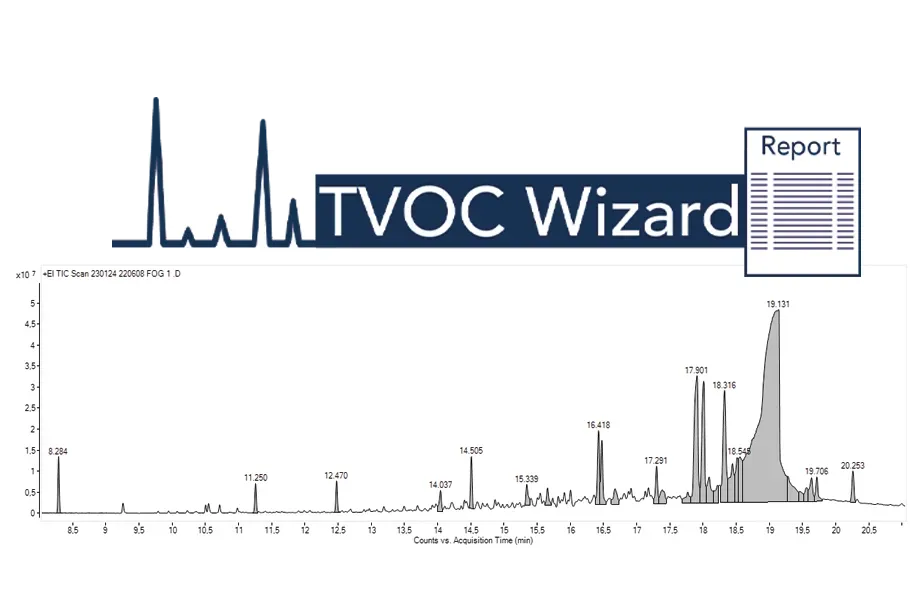
Automatisierter TVOC Wizard-Workflow:
Vereinfachung der Datenverarbeitung

Einsatz der stir bar sorptive extraction für die Analyse biogener Amine in Wein

Sensory Directed Analysis Workshops in Deutschland, China und Singapur

Neue AppNote: Sensory-Active Compounds in Cannabis
GERSTEL Applikationen
Hintergrundwissen in einem kompakten Format: Während unsere umfassenden AppNotes detaillierte Analysen und technische Anleitungen bieten, konzentrieren sich die AppBriefs darauf, die wichtigsten Erkenntnisse und Daten in einem übersichtlichen, zweiseitigen Format zu präsentieren.

GERSTEL erleben
Unser neustes Video

